Isotopi
04 SETTEMBRE 2023
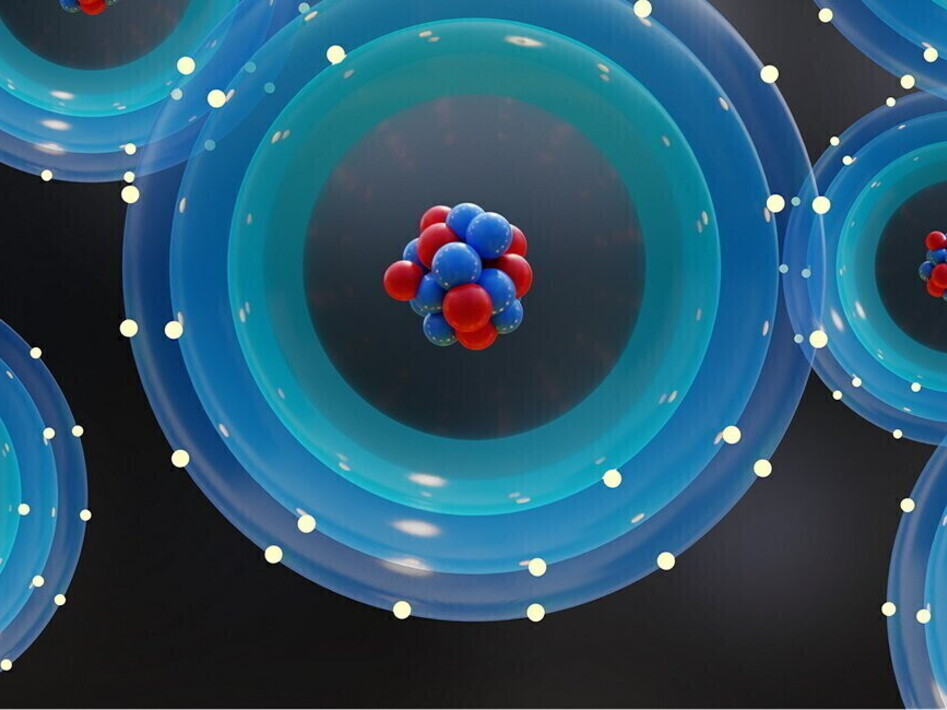
Un elemento della tavola periodica si distingue da un altro per il numero di protoni contenuti nel suo nucleo. Per esempio, tutti gli atomi di idrogeno hanno un protone nel nucleo, mentre quelli di carbonio ne hanno sei. Il numero di protoni nel nucleo è detto numero atomico, mentre la somma delle particelle del nucleo (protoni e neutroni) determina il numero di massa. Ciò che può cambiare tra due atomi dello stesso elemento è la quantità di neutroni presenti nel nucleo e quindi il numero di massa. Gli atomi di uno stesso elemento con numero di massa differente vengono denominati isotopi, poiché occupano la stessa posizione nella tavola periodica. Tra gli isotopi di un elemento ne esiste sempre uno più abbondante, mentre gli altri sono presenti in piccole quantità. Per esempio, in natura esistono tre isotopi del carbonio: il 99% è rappresentato dal 12C, il resto da 13C e 14C.



